Broncopneumopatia cronica ostruttiva (BPCO)

La BPCO è una malattia polmonare potenzialmente letale, ad alta prevalenza, che rientra tra le principali cause di mortalità e disabilità al mondo ma è ancora frequentemente sottodiagnosticata e nella sua gestione restano molte esigenze non soddisfatte.1-3
PARTE 1
Conoscere la BPCO
Cos’è la BPCO?
La broncopneumopatia cronica ostruttiva (BPCO) è una malattia polmonare comune che causa restrizione del flusso d’aria e difficoltà respiratorie sempre più gravi.
La Global Initiative for Chronic Obstructive Lung Disease (GOLD) definisce la BPCO una condizione polmonare eterogenea caratterizzata da sintomi respiratori cronici dovuti ad anomalie delle vie aeree e/o degli alveoli che causano un’ostruzione persistente e spesso progressiva del flusso d’aria.3
Sintomi principali
I sintomi includono dispnea, tosse e produzione di muco.
Anche se la BPCO è una malattia cronica, un numero sostanziale di pazienti soffre di esacerbazioni acute della BPCO (AECOPD), che sono definite dalla GOLD come un evento caratterizzato da aumento della dispnea e/o della tosse e del muco che peggiora in meno di 14 giorni, può essere accompagnato da tachipnea e/o tachicardia ed è spesso associato ad aumento dell’infiammazione locale e sistemica causato da infezioni, inquinamento o altri danni alle vie aeree.3
I dati derivanti da varie coorti di pazienti indicano che fino al 70% dei pazienti manifesta almeno una riacutizzazione infettiva nella BPCO (AECOPD) durante un periodo di follow-up di 1‑5 anni.4
L’AECOPD spesso richiede cure urgenti, aumento dei farmaci e/o ricovero ospedaliero, con conseguente aumento sostanziale dei costi.5
Fisiopatologia
Si ritiene che la BPCO sia causata da un mix di fattori genetici e ambientali, principalmente fumo di tabacco ed esposizione all’inquinamento (esposizione professionale e inquinamento domestico dovuto a combustione del legno e di altri combustibili da biomassa).3
Poiché la BPCO è una malattia eterogenea, un team di specialisti esperti raccomanda di classificarla in base ai meccanismi causali sottostanti al fine di sviluppare approcci personalizzati al trattamento.2
Peso della malattia
La BPCO crea un peso economico1 e sociale sostanziale.6-7
La BPCO ha un impatto sulla qualità della vita (QoL) e sul benessere mentale dei pazienti: la BPCO è associata a una salute fisica e a uno stato di salute specifico della malattia peggiori (rispetto alle persone non affette da BPCO)8 e a un’elevata incidenza di comorbilità psichiatriche9, inclusa la depressione.10, 11
La BPCO è la 3a causa di morte al mondo e la 7a causa di morbilità.12
I pazienti con BPCO sono a rischio di frequenti ricoveri ospedalieri, che sono associati a distress emotivo: quasi 1 paziente su 5 che si reca al pronto soccorso viene ricoverato almeno una volta nel corso dell’anno a seguito della prima visita.13
Le AECOPD sono associate a declino della funzione polmonare14, peggioramento della QoL15, 16, riduzione dell’attività fisica17, depressione18, nuovi ricoveri, ulteriori AECOPD e morte.19, 20
Comorbilità
Il carico di comorbilità è elevato, specialmente malattie cardiovascolari e diabete3:
- le più frequenti sono ipertensione, coronaropatie, diabete, osteoartrite, malattie psichiatriche, asma e apnea ostruttiva del sonno (OSA)21, 22.
- Le comorbilità possono influenzare le condizioni cliniche e la prognosi di un paziente e richiedono un trattamento: alcune condizioni come insufficienza cardiaca, cardiopatia ischemica, disturbi del sonno e depressione/ansia sono associate alla AECOPD.3, 23 L’OSA può peggiorare l’ipossiemia notturna e aumentare il rischio di ipertensione polmonare.22
Decadimentofisico
I pazienti BPCO spesso presentano una “spirale discendente” dello stato di salute: gli effetti sistemici portano a comorbilità cardiovascolari, riduzione della massa muscolare e osteoporosi, che a loro volta portano a ulteriore inattività e decadimento fisico. Allo stesso modo, le esacerbazioni portano a riduzione della funzione polmonare, inattività fisica e declino della salute mentale.24
Conoscere la BPCO

La BPCO è una malattia polmonare progressiva, che si manifesta principalmente con ostruzione del flusso d’aria, ed è associata a riduzione della QoL del paziente e aumento del rischio di morte. Quanto è comune la BPCO e come viene diagnosticata?
PARTE 2
Prevalenza e diagnosi
Prevalenza
Le stime della prevalenza variano, ma si ritiene che ~480 milioni di persone convivano con la BPCO nel mondo25 e l’incidenza è aumentata di oltre l’85% tra il 1990 e il 201926, con ulteriori aumenti previsti nei prossimi decenni a causa della continua esposizione a fattori di rischio, all’invecchiamento della popolazione e alla maggiore consapevolezza e diagnosi.3
Diagnosi
I segni e i sintomi della BPCO possono variare in pazienti diversi e da un giorno all’altro. Si dovrebbe comunque prendere in considerazione una possibile diagnosi in qualunque paziente con dispnea persistente e tosse cronica (intermittente o continua) con o senza produzione di muco e anamnesi di infezioni ricorrenti delle vie respiratorie inferiori e/o esposizione a fattori di rischio come fumo o inquinamento.3
Il metodo diagnostico gold standard è la spirometria (presenza di limitazione delle vie aeree non pienamente reversibile con rapporto FEV1/FVC post-broncodilatatore <0,7) insieme all’anamnesi clinica e alla presenza di fattori di rischio.3
Valutazioni di supporto per escludere diagnosi differenziali possono includere imaging (radiografia o TC del torace), emogasanalisi arteriosa (per rilevare ipossiemia/ipercapnia) e analisi dell’espettorato (utile in pazienti che presentano AECOPD).3
Diagnosi: esigenze insoddisfatte
Globalmente, si riscontra un’ampia variazione nella prevalenza riferita della BPCO, con il 10-95% dei pazienti sottodiagnosticati, spesso a causa di uso insufficiente o mancanza di disponibilità di metodi diagnostici,27 con alcuni pazienti che non riescono ad accedere a strutture diagnostiche o a cure sanitarie appropriate.
Gli esperti hanno evidenziato diversi punti deboli nei metodi e nei criteri diagnostici attuali. La spirometria post-broncodilatatore non è predittiva dei sintomi e non rileva variazioni patologiche precoci. Inoltre, la spirometria è spesso sottoutilizzata o interpretata scorrettamente. Un team di esperti suggerisce che tecniche moderne come l’imaging potrebbero essere usate per rilevare la malattia lieve prima che compaiano alterazioni patologiche irreversibili.2
Classificazione della gravità
Per guidare l’approccio terapeutico, la GOLD raccomanda di classificare la BPCO in base al livello di ostruzione del flusso d’aria (GOLD 1-4) e in base all’anamnesi di sintomi/esacerbazioni3:
- Il livello di ostruzione del flusso d’aria varia da lieve (GOLD 1) a molto grave (GOLD 4) a seconda del FEV1
- La gravità dei sintomi varia da GOLD A (basso carico di sintomi: mMRC 0-1 o CAT <10, anamnesi di esacerbazioni limitate: ≤1 esacerbazione moderata) e GOLD B (alto carico di sintomi: mMRC ≥2 o CAT ≥10, anamnesi di esacerbazioni limitate: ≤1 esacerbazione moderata), a GOLD E (qualsiasi carico di sintomi, rischio elevato di esacerbazioni: ≥2 esacerbazioni moderate o ≥1 che ha causato ricovero)
Prevalenza e diagnosi

La BPCO è una condizione polmonare eterogenea a elevata prevalenza. Mentre i sintomi possono essere variabili, il gold standard per la diagnosi è il rapporto FEV1/FVC post-broncodilatatore. L’anamnesi di esacerbazioni e il carico dei sintomi vengono anch’essi valutati per determinare la gravità della malattia. In che modo viene usata la classificazione della gravità per determinare la scelta del trattamento?
PARTE 3
Trattamento e prognosi
Obiettivi del trattamento
La scelta del trattamento della BPCO dipende dalla gravità dei sintomi* e ha lo scopo di alleviare i sintomi riducendo al contempo la progressione della malattia, le esacerbazioni e la mortalità.
Gli interventi includono cambiamenti dello stile di vita, terapia farmacologica e supporto ventilatorio/di ossigeno, come ossigenoterapia a lungo termine e terapia ad alti flussi (Figura).
*La relazione 2023 della GOLD sulla BPCO riconosce tre gruppi di gravità dei sintomi: “A”, “B” ed “E”.3
Linee guida
Le informazioni contenute nelle sezioni seguenti non sono destinate a sostituire le linee guida locali o le raccomandazioni di associazioni di esperti. Controllare le ultime linee guida locali/internazionali per prendere decisioni terapeutiche informate. Sono elencati di seguito alcuni link pertinenti:
https://goldcopd.org/2023-gold-report-2/
Modifiche comportamentali/dello stile di vita
I cambiamenti del comportamento e dello stile di vita includono smettere di fumare e la riabilitazione polmonare (esercizi associati a educazione del paziente).
Entrambe queste strategie hanno dimostrato di ridurre la mortalità nei pazienti con BPCO.3
Trattamenti farmacologici
I trattamenti farmacologici possono ridurre i sintomi e la frequenza e la gravità di AECOPD e migliorare lo stato di salute e la tolleranza all’esercizio fisico.3
I regimi devono essere personalizzati in base a gravità dei sintomi, rischio di esacerbazioni, effetti collaterali, comorbilità dei pazienti e disponibilità/costo dei farmaci, oltre che alle preferenze del paziente.3
GOLD raccomanda broncodilatatori inalatori che sono fondamentali per la gestione dei sintomi in quanto rilassano o prevengono la contrazione dei muscoli lisci delle vie aeree.3
Possono essere prescritti antibiotici per i pazienti durante le AECOPD o per prevenirle.28, 29 I pazienti dovrebbero anche ricevere vaccinazioni per prevenire le infezioni che potrebbero portare a AECOPD.3
I mucolitici riducono il rischio di AECOPD in alcuni pazienti e sono raccomandati da ERS/ATS per i pazienti con limitazione moderata o grave del flusso d’aria e AECOPD nonostante una terapia inalatoria ottimale.3, 29
Ossigenoterapia
L’ossigenoterapia può fornire sollievo dall’ipossiemia e ridurre lo sforzo respiratorio. L’ossigenoterapia a lungo termine deve essere rivalutata periodicamente ed è raccomandata da GOLD e ATS per i pazienti con grave ipossiemia a riposo, nei quali è associata a un piccolo aumento della sopravvivenza.3, 30, 31
L’ossigeno può essere erogato attraverso un concentratore di ossigeno, una bombola di ossigeno compresso o liquido o in aggiunta alla ventilazione.
Terapia ad alti flussi (HFT)
L’HFT eroga una miscela umidificata e riscaldata di aria, con o senza ossigeno, e può essere utile per i pazienti con tosse cronica e produzione di muco, sintomi che possono essere difficili da trattare con le sole terapie standard.32
L’HTF è studiata per essere somministrata attraverso una cannula nasale per alti flussi (NHFC). L’HFT domiciliare può erogare un flusso di 10-60 L/min o 10-15 L/min se viene aggiunto ossigeno. La configurazione utilizzata dipende dalle esigenze del paziente.
Alcuni dei vantaggi della HFT includono migliore gestione delle secrezioni,33 riduzione della dispnea,34-36 riduzione dello spazio morto,37 miglioramento del comfort dei pazienti33, 37 e riduzione delle AECOPD.32, 38
Maggiori informazioni sulla HFT qui e sui vantaggi della HFT per i pazienti con BPCO qui.
Ventilazione non invasiva (NIV) domiciliare
La NIV è raccomandata da GOLD ed ERS per i pazienti stabili con ipercapnia cronica severa e anamnesi di ospedalizzazione per insufficienza respiratoria acuta.3, 39-41
- I vantaggi includono miglioramento della sopravvivenza e della QoL e riduzione del rischio di ricovero ospedaliero.39, 40
- A seguito di una AECOPD, la NIV combinata con l’ossigenoterapia domiciliare ha dimostrato di prolungare significativamente il tempo alla riospedalizzazione o alla morte e di ridurre ulteriori AECOPD40 e ha un buon rapporto costo-efficacia.42
- I dati degli studi clinici evidenziano l’importanza di un’attenta valutazione del fenotipo del paziente e della tempistica e della somministrazione della NIV domiciliare per garantire la selezione di pazienti con maggiore probabilità di trarne beneficio.43
Maggiori informazioni sulle evidenze cliniche e la selezione dei pazienti per la NIV domiciliare qui .
Accorgimenti per la NIV domiciliare
Le considerazioni riguardanti le migliori metodologieper la NIV domiciliare includono un’accurata selezione dei pazienti che potrebbero con maggiore probabilità beneficiare dal trattamento, la somministrazione di una terapia efficace e ben tollerata e un attento monitoraggio degli effetti del trattamento.
Il miglioramento dei livelli elevati di biossido di carbonio arterioso dovrebbe essere uno dei principali obiettivi della NIV domiciliare e i dati degli studi clinici mostrano che pressioni inspiratorie maggiori contribuiscono al successo della terapia NIV domiciliare.39, 40, 44
Maggiori informazioni sulle migliori prassi per la NIV domiciliare qui .
NIV per eventi acuti
La GOLD raccomanda anche la NIV per il trattamento delle AECOPD in casi di acidosi respiratoria/dispnea severa con segni clinici che suggeriscano affaticamento dei muscoli respiratori/ipossiemia persistente nonostante la somministrazione di ossigeno supplementare.3
L’ERS/ATS raccomanda la NIV per l’insufficienza respiratoria ipercapnica acuta su cronica dovuta ad AECOPD.28
Rapporto costo-efficacia dell’avvio della NIV a domicilio invece che in ospedale
La NIV ha un rapporto costo-efficacia particolarmente favorevole quando effettuata a domicilio, invece che in ospedale (Dati in inglese).45
Nei pazienti con ipercapnia persistente in seguito a una AECOPD potenzialmente letale, NIV + ossigenoterapia domiciliare hanno presentato una maggiore probabilità di un rapporto costo-efficacia favorevole nel Regno Unito (Tabella in inglese).
Scelta di LTOT, HFT o NIV
È possibile utilizzare LTOT, HFT domiciliare e NIV domiciliare separatamente o in combinazione per il trattamento domiciliare dei pazienti affetti da BPCO. Alcuni dei vantaggi di questo approccio sono illustrati nella tabella (in inglese).
Pressione continua positiva delle vie aeree (CPAP)
Anche la CPAP può essere utile per alcuni pazienti e ha dimostrato di migliorare la sopravvivenza e ridurre il rischio di ospedalizzazione in pazienti affetti da BPCO e da apnea ostruttiva del sonno.3
Chirurgia
Le opzioni chirurgiche includono riduzione del volume polmonare, bullectomia e trapianto di polmone.
Prognosi
Anche se la BPCO è una malattia progressiva, un trattamento appropriato può ridurre i sintomi, la frequenza e la gravità delle esacerbazioni e migliorare lo stato di salute e la tolleranza all’esercizio fisico.3
Alcuni trattamenti possono anche rallentare la velocità di declino della funzione polmonare e ridurre la mortalità.3
L’ossigenoterapia a lungo termine ha dimostrato di migliorare la sopravvivenza in pazienti con ipossiemia grave a riposo e la NIV riduce la mortalità e previene la riospedalizzazione in pazienti con ipercapnia cronica severa.3
La BPCO non trattata può portare a insufficienza respiratoria acuta o cronica. I pazienti sono particolarmente a rischio durante una AECOPD poiché un aumento dell’ostruzione delle vie aeree lascia l’apparato respiratorio vulnerabile al sovraccarico.
Sguardo al futuro
Vi è un bisogno urgente di fare di più per contrastare la BPCO a livello mondiale.46
Un team di specialisti esperti che scrivono per Lancet nota che una risposta internazionale coordinata (come è avvenuto per il COVID-19) può superare le barriere esistenti nei confronti del trattamento e portare a risultati rapidi. In particolare, sostiene2:
- Strategie di salute pubblica per vietare il fumo e mantenere pulita l’aria
- Un approccio personalizzato alla medicina, basato su una valutazione esaustiva della fisiopatologia e dei sintomi della malattia, nonché delle esigenze, capacità e preferenze dei pazienti
- Investimenti ulteriori nelle terapia curative e rigenerative per andare oltre le opzioni di trattamento prettamente sintomatiche
- Maggiore attenzione alle AECOP che svolgono un ruolo cruciale nella progressione della malattia e nei costi ma tendono a essere definite in modo impreciso e studiate in modo insufficiente
Leggere l’infografica per esplorare ulteriormente alcune delle principali esigenze insoddisfatte nella cura della BPCO;
Trattamento e prognosi

La BPCO è una malattia progressiva che influisce in modo sostanziale sulla QoL dei pazienti ed è una causa importante di morbilità e mortalità in tutto il mondo.3, 6, 12 Il trattamento appropriato, tuttavia, ha dimostrato di migliorare i sintomi, la frequenza e la gravità delle AECOPD,3, 32 e, nei pazienti con BPCO e ipercapnia cronica trattati con ventilazione non invasiva, la sopravvivenza.39
Il parere dell’esperto
Intervista, Dott. Chris Carlin
Le modalità automatiche e il telemonitoraggio possono supportare e semplificare la NIV e le cure di buona qualità nella BPCO e nella OHS?
Intervista, Prof. Gonzalez-Bermejo
Come usare la NIV ad alta intensità in pazienti domiciliari con BPCO.
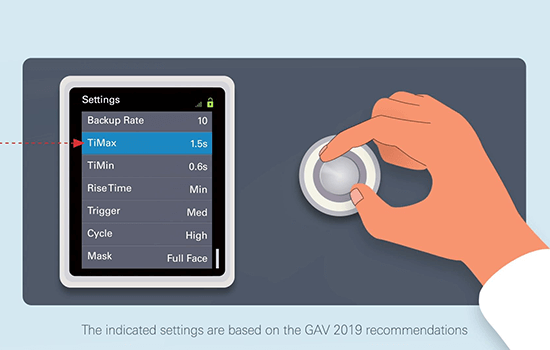
Raccomandazioni pratiche per l’uso della NIV domiciliare**
Questi video esplicativi sull’uso della NIV domiciliare sono destinati ai soli operatori sanitari.
Continua a esplorare

Malattia neuromuscolare (NMD)
Il termine “malattia neuromuscolare” (NMD) è un termine ampio che riunisce molte malattie e disturbi che interessano la funzione muscolare, sia direttamente (attraverso patologie muscolare intrinseche) che indirettamente (attraverso patologie nervose).

Sindrome da obesità-ipoventilazione (OHS)
Scopri di più su questa condizione, inclusa la sua prevalenza, come viene diagnosticata e le opzioni di trattamento disponibili.

Clinical Respiratory News
ResMed cambia la vita con i propri dispositivi medici e applicazioni software su cloud all’avanguardia che diagnosticano, trattano e gestiscono i disturbi respiratori del sonno (DRS), la broncopneumopatia cronica ostruttiva (BPCO) e altre malattie respiratorie croniche.
Questo contenuto è destinato esclusivamente agli operatori sanitari.
** Questi video esplicativi sull’uso della NIV domiciliare sono destinati ai soli operatori sanitari e sono basati sulle raccomandazioni del 2019 del GAV, che sono a loro volta basate sulla letteratura e sulle indicazioni di terapisti respiratori esperti. Il protocollo di cura resta di responsabilità del medico prescrittore e le impostazioni del dispositivo devono essere scelte in base alle esigenze del singolo paziente.
Riferimenti
- Iheanacho, I., et al., Economic Burden of Chronic Obstructive Pulmonary Disease (COPD): A Systematic Literature Review. Int J Chron Obstruct Pulmon Dis, 2020. 15: p. 439-460.
- Stolz, D., et al., Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet, 2022. 400(10356): p. 921-972.
- Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Prevention, Diagnosis and Management of COPD: 2023 Report 2023. Available at https://goldcopd.org/2023-gold-report-2/
- Hoogendoorn, M., et al., Prediction models for exacerbations in different COPD patient populations: comparing results of five large data sources. Int J Chron Obstruct Pulmon Dis, 2017. 12: p. 3183-3194.
- Dalal, A.A., et al., Impact of COPD Exacerbation Frequency on Costs for a Managed Care Population. J Manag Care Spec Pharm, 2015. 21(7): p. 575-83.
- Svedsater, H., et al., Life Impact and Treatment Preferences of Individuals with Asthma and Chronic Obstructive Pulmonary Disease: Results from Qualitative Interviews and Focus Groups. Adv Ther, 2017. 34(6): p. 1466-1481.
- Cook, N.S., et al., Patients’ perspectives on COPD: findings from a social media listening study. ERJ Open Res, 2019. 5(1).
- Franssen, F.M.E., et al., The physical, mental, and social impact of COPD in a population-based sample: results from the Longitudinal Aging Study Amsterdam. NPJ Prim Care Respir Med, 2018. 28(1): p. 30.
- FitzGerald, J.M., et al., Resource use study in COPD (RUSIC): a prospective study to quantify the effects of COPD exacerbations on health care resource use among COPD patients. Can Respir J, 2007. 14(3): p. 145-52.
- Omachi, T.A., et al., Depression and health-related quality of life in chronic obstructive pulmonary disease. Am J Med, 2009. 122(8): p. 778 e9-15.
- Zhang, M.W., et al., Prevalence of depressive symptoms in patients with chronic obstructive pulmonary disease: a systematic review, meta-analysis and meta-regression. Gen Hosp Psychiatry, 2011. 33(3): p. 217-23.
- GBD 2019 Diseases and Injuries Collaborators, Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet, 2020. 396(10258): p. 1204-1222.
- Yeatts, K.B., et al., Population-based burden of COPD-related visits in the ED: return ED visits, hospital admissions, and comorbidity risks. Chest, 2013. 144(3): p. 784-793.
- Donaldson, G.C., et al., Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax, 2002. 57(10): p. 847-52.
- Miravitlles, M., et al., Effect of exacerbations on quality of life in patients with chronic obstructive pulmonary disease: a 2 year follow up study. Thorax, 2004. 59(5): p. 387-95.
- Seemungal, T.A., et al., Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med, 1998. 157(5 Pt 1): p. 1418-22.
- Ehsan, M., et al., A longitudinal study evaluating the effect of exacerbations on physical activity in patients with chronic obstructive pulmonary disease. Ann Am Thorac Soc, 2013. 10(6): p. 559-64.
- Alahmari, A.D., et al., Physical activity and exercise capacity in patients with moderate COPD exacerbations. Eur Respir J, 2016. 48(2): p. 340-9.
- Suissa, S., S. Dell’Aniello, and P. Ernst, Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax, 2012. 67(11): p. 957-63.
- Connors, A.F., Jr., et al., Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med, 1996. 154(4 Pt 1): p. 959-67.
- Santos, N.C.D., et al., Prevalence and Impact of Comorbidities in Individuals with Chronic Obstructive Pulmonary Disease: A Systematic Review. Tuberc Respir Dis (Seoul), 2022. 85(3): p. 205-220.
- Soler, X., et al., High Prevalence of Obstructive Sleep Apnea in Patients with Moderate to Severe Chronic Obstructive Pulmonary Disease. Ann Am Thorac Soc, 2015. 12(8): p. 1219-25.
- Stallberg, B., et al., Real-world retrospective cohort study ARCTIC shows burden of comorbidities in Swedish COPD versus non-COPD patients. NPJ Prim Care Respir Med, 2018. 28(1): p. 33.
- Hurst, J.R., et al., Understanding the impact of chronic obstructive pulmonary disease exacerbations on patient health and quality of life. Eur J Intern Med, 2020. 73: p. 1-6.
- Boers, E., et al. An estimate of the global COPD prevalence in 2050: Disparities by income and gender. Poster presented at the European Respiratory Society International Congress 2022. Barcelona, Spain.
- Li, H.Y., et al., Global, regional and national burden of chronic obstructive pulmonary disease over a 30-year period: Estimates from the 1990 to 2019 Global Burden of Disease Study. Respirology, 2023. 28(1): p. 29-36.
- Ho, T., et al., Under- and over-diagnosis of COPD: a global perspective. Breathe (Sheff), 2019. 15(1): p. 24-35.
- Wedzicha, J.A.E.C.-C., et al., Management of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J, 2017. 49(3).
- Wedzicha, J.A., et al., Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J, 2017. 50(3).
- Jacobs, S.S., et al., Home Oxygen Therapy for Adults with Chronic Lung Disease. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med, 2020. 202(10): p. e121-e141.
- Cranston, J.M., et al., Domiciliary oxygen for chronic obstructive pulmonary disease. Cochrane Database Syst Rev, 2005. 2005(4): p. CD001744.
- Storgaard, L.H., et al., Long-term effects of oxygen-enriched high-flow nasal cannula treatment in COPD patients with chronic hypoxemic respiratory failure. Int J Chron Obstruct Pulmon Dis, 2018. 13: p. 1195-1205.
- Hasani, A., et al., Domiciliary humidification improves lung mucociliary clearance in patients with bronchiectasis. Chron Respir Dis, 2008. 5(2): p. 81-6.
- Cirio, S., et al., Effects of heated and humidified high flow gases during high-intensity constant-load exercise on severe COPD patients with ventilatory limitation. Respir Med, 2016. 118: p. 128-132.
- Neunhauserer, D., et al., Supplemental Oxygen During High-Intensity Exercise Training in Nonhypoxemic Chronic Obstructive Pulmonary Disease. Am J Med, 2016. 129(11): p. 1185-1193.
- Chatila, W., et al., The effects of high-flow vs low-flow oxygen on exercise in advanced obstructive airways disease. Chest, 2004. 126(4): p. 1108-15.
- Fraser, J.F., et al., Nasal high flow oxygen therapy in patients with COPD reduces respiratory rate and tissue carbon dioxide while increasing tidal and end-expiratory lung volumes: a randomised crossover trial. Thorax, 2016. 71(8): p. 759-61.
- Rea, H., et al., The clinical utility of long-term humidification therapy in chronic airway disease. Respir Med, 2010. 104(4): p. 525-33.
- Kohnlein, T., et al., Non-invasive positive pressure ventilation for the treatment of severe stable chronic obstructive pulmonary disease: a prospective, multicentre, randomised, controlled clinical trial. Lancet Respir Med, 2014. 2(9): p. 698-705.
- Murphy, P.B., et al., Effect of Home Noninvasive Ventilation With Oxygen Therapy vs Oxygen Therapy Alone on Hospital Readmission or Death After an Acute COPD Exacerbation: A Randomized Clinical Trial. JAMA, 2017. 317(21): p. 2177-2186.
- Ergan, B., et al., European Respiratory Society guidelines on long-term home non-invasive ventilation for management of COPD. Eur Respir J, 2019. 54(3).
- Murphy, P.B., et al., Cost-effectiveness of home non-invasive ventilation in patients with persistent hypercapnia after an acute exacerbation of COPD in the UK. Thorax, 2023. 78(5): p. 523-525.
- Murphy, P.B. and N. Hart, Home Non-Invasive Ventilation for COPD: How, Who and When? Arch Bronconeumol (Engl Ed), 2018. 54(3): p. 149-154.
- Windisch, W., J.H. Storre, and T. Kohnlein, Nocturnal non-invasive positive pressure ventilation for COPD. Expert Rev Respir Med, 2015. 9(3): p. 295-308.
- Duiverman, M.L., et al., Home initiation of chronic non-invasive ventilation in COPD patients with chronic hypercapnic respiratory failure: a randomised controlled trial. Thorax, 2020. 75(3): p. 244-252.
- Halpin, D.M.G., et al., It is time for the world to take COPD seriously: a statement from the GOLD board of directors. Eur Respir J, 2019. 54(1).